I livelli energetici dell'atomo di idrogeno
L'atomo di idrogeno è l'elemento più
semplice in natura. L'idrogeno neutro è infatti costituito da un
elettrone che "orbita" intorno a un nucleo
formato da un solo protone.
Per ricavare i livelli energetici e le orbite
permesse di un atomo di idrogeno, Bohr aggiunge, alle due
ipotesi viste in precedenza, una terza ipotesi aggiuntiva:
3.
le orbite permesse sono quelle per le quali il momento angolare è
un multiplo intero di h/2p.
Queste tre ipotesi insieme sono soddisfatte
soltanto se l'elettrone non è libero di orbitare intorno al nucleo
su un'orbita circolare di raggio qualsiasi, come invece accade per i pianeti
intorno al Sole.
Un elettrone è invece costretto a orbitare intorno al nucleo su
orbite circolari con valori particolari del raggio. Inoltre, per l'atomo
di idrogeno, a ogni valore dell'orbita corrisponde un solo valore di energia.
Numerando le orbite possibili a partire da quella più vicina al
nucleo dell'atomo, possiamo esprimere i valori del raggio an
e dell'energia En con le seguenti formule:
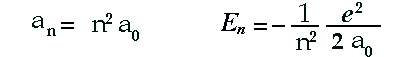
Il simbolo e indica la carica dell'elettrone (carica elementare),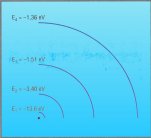 mentre il simbolo a0 è il raggio dell'orbita più vicina al nucleo e coincide con il valore atteso per le dimensioni dell'atomo di idrogeno: a0 = 0,5 A.
mentre il simbolo a0 è il raggio dell'orbita più vicina al nucleo e coincide con il valore atteso per le dimensioni dell'atomo di idrogeno: a0 = 0,5 A.
L'energia E1 dello stato fondamentale, cioè dello stato di minima energia dell'atomo, si ottiene dalla formula sostituendo ai simboli il loro valore e al numero n il numero intero 1. Un semplice calcolo dà E1 = 13,6 eV.
Analogamente si procede per calcolare il valore dei raggi e delle energie delle orbite successive.
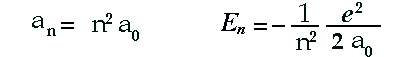
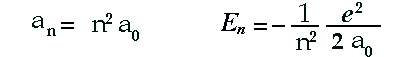
 mentre il simbolo a0 è il raggio dell'orbita più vicina al nucleo e coincide con il valore atteso per le dimensioni dell'atomo di idrogeno: a0 = 0,5 A.
mentre il simbolo a0 è il raggio dell'orbita più vicina al nucleo e coincide con il valore atteso per le dimensioni dell'atomo di idrogeno: a0 = 0,5 A.