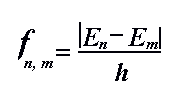
Lo spettro dell'atomo di idrogeno
Quando un atomo di idrogeno viene eccitato, per esempio con del calore, assorbe quantità di energia corrispondenti alle
differenze di energia fra i livelli che abbiamo calcolato.
Poiché la radiazione è una forma di energia, se l'atomo viene illuminato in maniera opportuna, assorbe pacchetti di energia (fotoni) grazie ai quali l'elettrone può saltare su orbite più lontane dal nucleo. I pacchetti che l'atomo assorbe, corrispondono a una ben determinata frequenza della radiazione incidente, come ricordato dalla formula
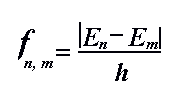
 Questa condizione di eccitazione è instabile, per cui l'elettrone tende a ricadere sul livello fondamentale. Ciò può avvenire direttamente con un "salto" inverso a quello fatto: in questo caso l'atomo emette luce alla frequenza espressa dalla formula di sopra.
Questa condizione di eccitazione è instabile, per cui l'elettrone tende a ricadere sul livello fondamentale. Ciò può avvenire direttamente con un "salto" inverso a quello fatto: in questo caso l'atomo emette luce alla frequenza espressa dalla formula di sopra.
| La spettroscopia | Dolores e la spettroscopia |