L'atomo di Bohr
Dall'analisi della radiazione
emessa e assorbita da un atomo, è
possibile capire come è fatto l'atomo stesso?
Ecco un paio di considerazione derivate
dagli esperimenti dell'epoca.
-
Nel caso del sodio,
abbiamo visto che lo spettro di
emissione
era uguale allo spettro di
assorbimento.
Questo però è vero solo se ci si limita ad osservare la parte
dello spettro che corrisponde alla luce visibile. Più in generale,
si trova che lo spettro di emissione è più ricco dello spettro
di assorbimento, cioè mostra le stesse righe dello spettro di assorbimento
più altre righe ancora;
-
Anche se la radiazione che incide sull'atomo
ha solo frequenze f maggiori di una certa frequenza f1,
lo spettro di emissione dell'atomo può mostrare righe a frequenze
minori di f1
Il fisico danese Bohr  dimostrò che questi due fatti erano compatibili con una struttura
dell'atomo diversa da quella prevista dalla fisica classica. Vediamo le
ipotesi di Bohr.
dimostrò che questi due fatti erano compatibili con una struttura
dell'atomo diversa da quella prevista dalla fisica classica. Vediamo le
ipotesi di Bohr.
-
Prima ipotesi: la configurazione elettronica
di un atomo (non ionizzato) prevede soltanto un insieme discreto di energie
possibili, dette livelli energetici dell'atomo.
-
Seconda ipotesi: l'emissione di radiazione o
di assorbimento da parte di un atomo ha luogo solo quando l'atomo passa
da uno stato di energia En a uno stato di
energia Em. In questo caso la frequenza f della
radiazione è legata al salto energetico dalla formula
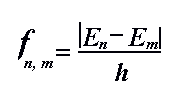 nella quale h è un costante (costante di Plank) che vale 6,6 10-27 erg s.
nella quale h è un costante (costante di Plank) che vale 6,6 10-27 erg s.
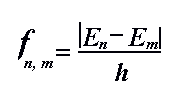
 dimostrò che questi due fatti erano compatibili con una struttura
dell'atomo diversa da quella prevista dalla fisica classica. Vediamo le
ipotesi di Bohr.
dimostrò che questi due fatti erano compatibili con una struttura
dell'atomo diversa da quella prevista dalla fisica classica. Vediamo le
ipotesi di Bohr.